La apendicitis ha sido durante décadas uno de los diagnósticos quirúrgicos más comunes y apremiantes en urgencias, una condición que exige rapidez, precisión y una buena dosis de experiencia clínica. Hoy, la inteligencia artificial (IA) irrumpe en ese escenario con promesas y preguntas: ¿puede ayudar a distinguir una apendicitis verdadera de otras causas de dolor abdominal? ¿Puede reducir errores, retrasos o intervenciones innecesarias? En este artículo vamos a explorar en profundidad cómo la IA se aplica al diagnóstico de apendicitis, qué técnicas se usan, qué evidencias existen, los beneficios potenciales, las limitaciones reales, y cómo podría integrarse en la práctica clínica cotidiana. Hablaré de conceptos técnicos en un lenguaje accesible, presentaré tablas y listados para organizar las ideas y propondré recomendaciones prácticas para médicos, gestores y desarrolladores interesados en el tema. Si más adelante desea que incorpore frases clave concretas o un glosario específico, coméntemelo y lo ajusto.
¿Qué es la apendicitis y por qué es un desafío diagnosticarla?
La apendicitis es la inflamación del apéndice vermiforme, generalmente causada por obstrucción del lumen, infección o ambos. Su presentación clínica puede variar desde dolor periumbilical que migra a fosa ilíaca derecha, hasta cuadros atípicos con náuseas, fiebre leve o síntomas gastrointestinales inespecíficos. En población pediátrica, ancianos y mujeres en edad reproductiva, el diagnóstico puede ser especialmente difícil por presentaciones atípicas y patologías que imitan una apendicitis (como enfermedad inflamatoria pélvica, gastroenteritis, diverticulitis, o torsión ovárica).
El reto mayor es doble: por un lado no retrasar una cirugía cuando el apéndice está comprometido (evitar complicaciones como perforación y sepsis), y por otro evitar apendicectomías innecesarias, que conllevan riesgos y costes. A ese binomio contribuyen limitaciones en los exámenes físicos, variabilidad interobservador, imperfecta sensibilidad/especificidad de estudios de imagen y disponibilidad dispar de recursos diagnósticos. Aquí es donde la IA entra con la promesa de añadir consistencia, velocidad y análisis de patrones que los humanos no detectan fácilmente.
¿Qué tipos de inteligencia artificial se aplican al diagnóstico de apendicitis?
La IA no es una sola herramienta, sino un conjunto de técnicas que varían en complejidad y propósito. En el contexto de apendicitis, las aplicaciones principales son las siguientes:
Modelos de aprendizaje automático tradicionales
Estos modelos (regresión logística, árboles de decisión, random forest, máquinas de soporte vectorial) aprovechan variables clínicas estructuradas —edad, temperatura, recuentos de leucocitos, duración del dolor, signos físicos— para generar predicciones de probabilidad. Son útiles cuando los datos están bien organizados y su transparencia (algunos modelos) facilita la interpretación clínica.
Redes neuronales profundas y aprendizaje profundo
Las redes neuronales, especialmente las convolucionales (CNN), se usan principalmente en el análisis de imágenes médicas: ecografías, tomografías computarizadas (TC) y, en menor medida, radiografías o imágenes de resonancia magnética. Estas redes pueden identificar patrones texturales y anatómicos sutiles que ayudan a distinguir un apéndice inflamado de uno normal o de otras patologías.
Sistemas híbridos y aprendizaje multimodal
Combinar datos clínicos estructurados con información de imágenes (aprender de ambos simultáneamente) suele mejorar la precisión. Los sistemas híbridos integran puntuaciones clínicas, datos de laboratorio y resultados de imagen para producir una predicción más robusta.
Procesamiento de lenguaje natural (PLN)
Menos común pero creciente: modelos que analizan notas médicas, descripciones de síntomas y registros electrónicos para extraer indicadores relevantes y alimentar modelos predictivos.
Cómo se entrenan estos modelos: datos, anotaciones y validación
Un modelo de IA es tan bueno como los datos con los que se entrena. Para apendicitis, los datos provienen de historias clínicas, bases de imágenes (ecografías, TC), resultados quirúrgicos y hallazgos histopatológicos. El flujo típico incluye:
- Recolección de datos: historias clínicas, imágenes, resultados de laboratorio y seguimientos.
- Anotación: radiólogos y cirujanos marcan imágenes (por ejemplo, apéndices normales vs. inflamados) y confirman diagnósticos con piezas quirúrgicas o seguimiento clínico.
- Preprocesamiento: normalización de imágenes, limpieza de datos y balanceo de clases para evitar sesgos.
- Entrenamiento: el modelo aprende a asociar entradas (imágenes + datos clínicos) con salidas (diagnóstico confirmado).
- Validación y prueba: se evalúa el modelo en conjuntos separados (validación cruzada, test externo) para medir su rendimiento realista.
Es vital que la validación incluya datos externos (procedentes de hospitales diferentes) para comprobar la generalizabilidad. También es importante reportar métricas como sensibilidad, especificidad, área bajo la curva ROC (AUC), valores predictivos y exactitud global.
Aplicaciones prácticas: imágenes y sistemas de apoyo al diagnóstico
La IA se está aplicando en varias etapas del proceso diagnóstico:
1. Interpretación de ecografías abdominales
La ecografía es la opción preferente en niños y mujeres embarazadas por ausencia de radiación. Sin embargo, depende en gran medida del operador. Los modelos de IA pueden ayudar a:
- Detectar automáticamente la presencia del apéndice.
- Medir el diámetro apendicular y detectar edema periappendicular.
- Clasificar estudios como “probable apendicitis”, “indeterminado” o “no apendicitis”.
Esto mejora la consistencia entre operadores y puede acelerar decisiones en centros con personal no experto.
2. Análisis de tomografías computarizadas (TC)
Las TC tienen alta precisión en apendicitis. Los modelos CNN pueden segmentar el apéndice, identificar signos de complicación (absceso, perforación) y ofrecer una segunda lectura que reduzca diagnósticos erróneos o demoras.
3. Integración con puntuaciones clínicas
Puntuaciones tradicionales como Alvarado, AIR o PAS tienen utilidad histórica. La IA puede combinar estas puntuaciones con otras variables y mejorar su rendimiento predictivo, proponiendo umbrales adaptativos según el perfil del paciente.
4. Sistemas de triage y apoyo en urgencias
En servicios de urgencias con alta demanda, sistemas IA pueden priorizar pacientes con mayor probabilidad de apendicitis para evaluación más rápida, optimizando recursos.
Ejemplos comparativos: cómo se comportan diferentes enfoques
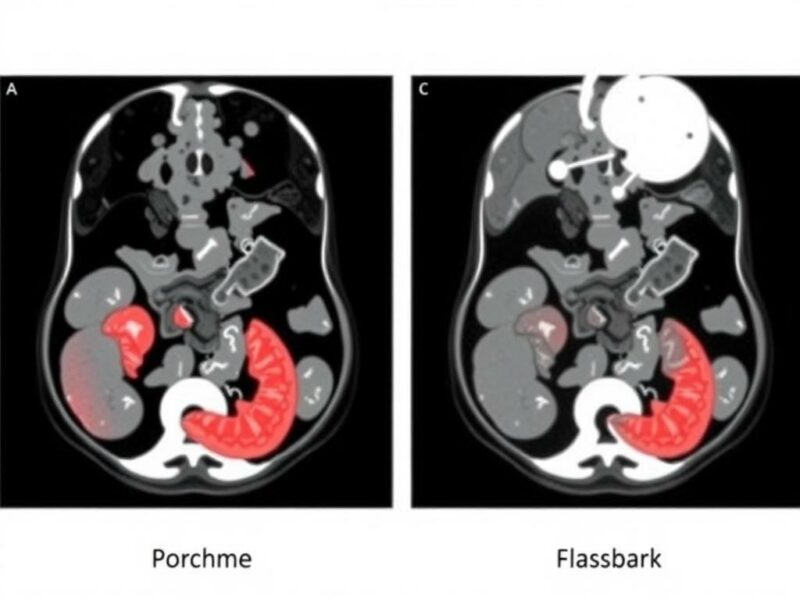
A continuación presento una tabla comparativa generalizada de enfoques de IA aplicados al diagnóstico de apendicitis. Los números son rangos típicos observados en la literatura y varían según estudios, poblaciones y calidad de los datos.
| Enfoque | Tipo de dato | Sensibilidad típica | Especificidad típica | Fortalezas | Limitaciones |
|---|---|---|---|---|---|
| Modelos ML (variables clínicas) | Historia clínica, laboratorio | 70–90% | 60–85% | Rápidos, interpretable (algunos) | Menos precisión si datos incompletos |
| Redes CNN (ecografía) | Imágenes ecográficas | 75–95% | 70–95% | Mejoran consistencia del operador | Calidad de imagen variable, necesidad de grandes datasets |
| Redes CNN (TC) | TC abdominal | 85–98% | 80–97% | Alta precisión, detecta complicaciones | Coste y exposición a radiación |
| Sistemas multimodales | Imágenes + clínicas | 90–98% | 85–97% | Mejor rendimiento global | Complejidad técnica e integración |
Estos rangos ilustran que los sistemas multimodales tienden a ofrecer los mejores resultados, pero requieren infraestructura, interoperabilidad y conjuntos de datos bien anotados.
Beneficios claros y potenciales de la IA en este campo
La adopción de IA en el diagnóstico de apendicitis ofrece ventajas concretas:
- Mayor precisión y consistencia en la interpretación de imágenes, particularmente en lugares con radiólogos no especialistas o en horario nocturno.
- Reducción de diagnósticos retrasados o erróneos, potencialmente disminuyendo complicaciones como perforación o sepsis.
- Disminución de apendicectomías negativas (cirugías innecesarias) al mejorar la confirmación diagnóstica.
- Mejor uso de recursos: priorización de pacientes, reducción de estudios redundantes.
- Formación y apoyo al personal más joven: la IA puede servir como tutor en tiempo real, mostrando por qué una imagen sugiere apendicitis.
Además, en contextos de investigación, los modelos pueden ayudar a descubrir nuevos biomarcadores o patrones clínico-radiológicos no evidentes a simple vista.
Limitaciones reales, sesgos y riesgos
La IA no es una solución mágica y existen riesgos y limitaciones importantes que es necesario reconocer:
Calidad y representatividad de los datos
Si los datos de entrenamiento provienen mayoritariamente de ciertos grupos demográficos (por ejemplo, adultos jóvenes de un país), el modelo puede fallar en poblaciones diferentes (niños, ancianos, distintas etnias). Los sesgos se traducen en inequidad en el cuidado.
Etiquetado imperfecto
Los diagnósticos de referencia (gold standard) deben ser fiables: idealmente confirmación quirúrgica/histopatológica o seguimiento clínico robusto. Etiquetas erróneas generan modelos menos útiles.
Generalización y sobreajuste
Un modelo que funciona muy bien en el hospital A puede fallar en el hospital B debido a diferencias en equipos de imagen, protocolos o prevalencia de enfermedad. Las validaciones externas son imprescindibles.
Interpretabilidad
Las redes profundas pueden ser “cajas negras”. La falta de explicaciones claras sobre por qué el modelo llegó a una conclusión puede reducir la confianza del clínico.
Regulación y responsabilidad legal
¿Quién es responsable si la IA falla y se produce un daño? Las leyes y normativas están en evolución y varían por país. Los sistemas deben cumplir con requisitos regulatorios de software médico.
Privacidad y seguridad de datos
El entrenamiento de modelos requiere grandes volúmenes de datos sanitarios. Es imprescindible proteger la privacidad y asegurar que los datos no se utilicen indebidamente.
Cómo evaluar un sistema de IA antes de desplegarlo en el hospital
No basta con que un estudio publicado muestre buenos resultados. Antes de integrar IA en la práctica clínica, se debe hacer una evaluación multidimensional:
- Revisión de la evidencia: ¿existen estudios con validación externa y comparación frente a estándar clínico?
- Pruebas locales: pilotaje con datos del propio centro para comprobar rendimiento y detectar sesgos.
- Análisis de usabilidad: ¿es intuitivo para el personal? ¿ofrece explicaciones o visualizaciones útiles?
- Evaluación de flujo de trabajo: ¿reduce tiempos y pasos o añade tareas extras?
- Seguridad y privacidad: cumplimiento de regulaciones locales e internacionales.
- Plan de monitoreo post-implementación: métricas continuas de rendimiento y mecanismos para actualización y retraining.
También recomiendo contar con un comité multidisciplinario (médicos, informática, ética, legal, pacientes) para evaluar el impacto global.
Aspectos regulatorios y éticos
La regulación de software de IA médica avanza, pero es heterogénea. En muchos países, un sistema que influye en decisiones clínicas puede ser considerado dispositivo médico y requerir aprobación (por ejemplo, CE en Europa, FDA en EE. UU.). Entre los puntos críticos están:
- Transparencia: documentación clara del desarrollo, datos de entrenamiento y limitaciones.
- Consentimiento y uso de datos: garantizar que los datos se han usado conforme a la ley.
- Equidad: pruebas de rendimiento en subgrupos demográficos para detectar sesgos.
- Responsabilidad: definir roles y procedimientos si la IA sugiere diagnósticos erróneos.
Ética clínica: la IA debe apoyar, no reemplazar, el juicio clínico. El objetivo es mejorar la atención centrada en el paciente, no deshumanizar el proceso.
Caso práctico hipotético: implementación paso a paso en un hospital regional
Imaginemos un hospital regional que quiere usar IA para mejorar el diagnóstico de apendicitis en urgencias. Un posible plan sería:
- Fase 1 — Evaluación: formar un equipo y revisar soluciones comerciales y evidencia científica.
- Fase 2 — Piloto técnico: probar un sistema en modo “segunda lectura” con datos históricos y validar métricas localmente.
- Fase 3 — Formación: capacitar a radiólogos, cirujanos y urgenciólogos en el uso y limitaciones de la herramienta.
- Fase 4 — Implementación gradual: empezar con horarios nocturnos o pacientes seleccionados y medir impacto (tiempo a diagnóstico, tasa de apendicectomías negativas, complicaciones).
- Fase 5 — Monitoreo y mejora continua: actualizar el modelo con nuevo entrenamiento y mantener registro de eventos adversos.
Este enfoque minimiza riesgos, permite adaptación y genera datos reales para evaluar costo-efectividad.
Métricas que importan: cómo medir si la IA está ayudando realmente
Más allá de sensibilidad y especificidad, algunas métricas prácticas que deberían monitorizarse son:
- Tiempo desde llegada a urgencias hasta decisión quirúrgica o alta.
- Tasa de apendicectomías negativas (cirugías sin apendicitis confirmada).
- Tasa de perforación al diagnóstico (indicador de retraso diagnóstico).
- Satisfacción del equipo clínico y del paciente.
- Costo por episodio: estudios adicionales, estancias y reintervenciones.
- Frecuencia de alertas falsas positivas/negativas y su impacto en carga de trabajo.
Un sistema que aumenta significativamente false positives, por ejemplo, puede sobrecargar quirófanos y generar más daño que beneficio.
Costes y retorno de inversión
Implementar IA implica costes (software, hardware, integración, formación y mantenimiento). Sin embargo, hay formas de medir retorno potencial:
- Reducción de procedimientos innecesarios y estancias hospitalarias.
- Disminución de complicaciones por diagnóstico temprano (menos ICU, menos rehabilitación).
- Optimización del tiempo médico y de radiólogos, permitiendo atender más pacientes con la misma plantilla.
Los análisis económicos deben contemplar horizonte temporal (el beneficio puede verse en meses o años) y costos recurrentes (licencias, actualización de modelos).
Formación y aceptación del personal clínico
La aceptación es clave. Estrategias efectivas incluyen:
- Involucrar a usuarios finales desde el diseño y pilotaje.
- Ofrecer sesiones prácticas y casos reales donde ver cómo la IA actúa como “segunda opinión”.
- Proveer transparencia: explicar qué datos usa el modelo y sus límites.
- Promover una cultura de aprendizaje: que la IA complemente el juicio clínico, no lo reemplace.
La confianza se construye con transparencia, formación y resultados comprobables.
Escenarios futuros: hacia diagnóstico más rápido y personalizado
Mirando adelante, podemos prever varios avances:
- Sistemas que integren wearables y síntomas previos para estimar riesgo antes de llegar al hospital.
- Modelos federados que entren en múltiples hospitales sin compartir datos sensibles, preservando privacidad.
- Herramientas de IA que no solo diagnostiquen, sino que recomienden manejo individualizado (observación vs cirugía vs antibióticos).
- Mayor interoperabilidad entre imágenes, registros electrónicos y algoritmos para flujos de trabajo más fluidos.
Estos avances dependerán tanto del progreso técnico como de la voluntad de invertir en infraestructura y gobernanza de datos.
Preguntas frecuentes rápidas
- ¿La IA sustituirá a los médicos? No. La IA es una herramienta de apoyo destinada a mejorar la precisión, reducir la variabilidad y acelerar procesos; la decisión final debe permanecer en manos clínicos.
- ¿Es segura la IA para niños o embarazadas? Los modelos deben validarse específicamente en estas poblaciones antes de aplicarlos; muchos estudios actuales se centran en adultos.
- ¿Qué pasa si la IA se equivoca? Es necesario tener protocolos claros: revisión humana, auditoría de casos y responsabilidades legales definidas.
- ¿Conviene comprar un sistema comercial o desarrollar uno propio? Depende de recursos. Las soluciones comerciales ofrecen despliegue más rápido; desarrollar internamente permite mayor control y adaptación local.
Checklist para implementar IA en diagnóstico de apendicitis
| Aspecto | ¿Listo? | Acción recomendada |
|---|---|---|
| Validación externa del modelo | No/Sí | Solicitar o realizar pruebas con datos locales |
| Compatibilidad con PACS y HCE | No/Sí | Asegurar interoperabilidad y flujos de trabajo |
| Plan de formación del personal | No/Sí | Organizar talleres y materiales de e-learning |
| Evaluación de impacto clínico | No/Sí | Definir métricas y periodo de seguimiento |
| Cumplimiento regulatorio | No/Sí | Verificar certificaciones y requisitos legales |
| Protección de datos | No/Sí | Implementar anonimización y seguridad |
Recomendaciones prácticas para médicos y gestores
Para quienes lideran servicios de urgencias o radiología y desean explorar la IA en apendicitis, sugiero:
- Empiece con pilotos específicos y medibles (por ejemplo, horas nocturnas) antes de escalar.
- Exija validación externa y revisión por pares de las soluciones comerciales.
- Involucre a pacientes y familias en decisiones sobre uso de IA en atención clínica.
- Mantenga registros detallados de desempeño y eventos adversos relacionados con el sistema.
- Promueva la colaboración con otros centros para construir datasets más diversos y robustos.
Estas acciones reducen riesgos y aumentan la probabilidad de éxito a largo plazo.
Investigación abierta y colaboraciones necesarias
Para que la IA cumpla su promesa en apendicitis, hacen falta colaboraciones interinstitucionales que:
- Compartir datasets anotados y estandarizados, respetando privacidad.
- Desarrollar benchmarks públicos para comparar modelos.
- Realizar ensayos clínicos que midan resultados relevantes (morbimortalidad, tasas de cirugía innecesaria, coste-efectividad).
- Estudiar impacto en subpoblaciones: niños, embarazadas, ancianos y grupos étnicos diversos.
La ciencia abierta y la gobernanza ética son pilares para avanzar con seguridad.
Reflexión final antes de la conclusión
La IA tiene un potencial real para transformar el diagnóstico de la apendicitis, desde mejorar lecturas de imagen hasta integrar datos clínicos complejos en segundos. Pero su adopción responsable requiere evidencia sólida, validación externa, atención a la equidad, protección de datos y un rol claro para el juicio clínico humano. Cuando estos elementos se alinean, la IA puede aportar rapidez, precisión y consistencia; cuando no, puede introducir nuevos riesgos. Por eso la implementación debe ser cuidadosa, iterativa y siempre centrada en el beneficio del paciente.
Conclusión
La inteligencia artificial en el diagnóstico de apendicitis ofrece una oportunidad tangible para mejorar la precisión, reducir variabilidad y optimizar recursos, integrando análisis de imágenes, datos clínicos y puntuaciones tradicionales en sistemas que apoyan la toma de decisiones; sin embargo, su efectividad depende de datos de alta calidad y representativos, validación externa, transparencia, cumplimiento regulatorio y salvaguardias éticas que preserven la equidad y la privacidad, por lo que su adopción debe hacerse mediante pilotos controlados, formación del personal, monitoreo continuo y colaboración institucional para asegurar que la IA complemente responsablemente la experiencia clínica en beneficio del paciente.